Résistance à la corrosion des métaux
Qu'est-ce que la résistance à la corrosion ?
La capacité d'un métal à résister à la corrosion est appelée résistance à la corrosion. Cette capacité est déterminée par le taux de corrosion dans certaines conditions. Des caractéristiques quantitatives et qualitatives sont utilisées pour évaluer le degré de corrosion.

Les caractéristiques qualitatives sont :
-
changer l'apparence de la surface métallique;
-
modification de la microstructure du métal.
Les caractéristiques quantitatives sont :
-
temps avant l'apparition du premier foyer de corrosion ;
-
le nombre de foyers de corrosion formés sur une certaine période de temps ;
-
amincissement du métal par unité de temps ;
-
changement de masse de métal par unité de surface par unité de temps ;
-
le volume de gaz absorbé ou libéré pendant la corrosion par unité de surface par unité de temps ;
-
densité de courant électrique pour un taux de corrosion donné ;
-
changement de propriété dans le temps (propriétés mécaniques, réflectivité, résistance électrique).
Différents métaux ont une résistance différente à la corrosion.Pour augmenter la résistance à la corrosion, des méthodes spéciales sont utilisées: alliage pour l'acier, chromage, aluminisation, nickelage, peinture, zingage, passivation, etc.
Fer et acier

En présence d'oxygène et d'eau pure, le fer se corrode rapidement, la réaction se déroule selon la formule :
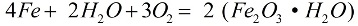
En cours de corrosion, une couche lâche de rouille recouvre le métal, et cette couche ne le protège pas du tout d'une destruction supplémentaire, la corrosion se poursuit jusqu'à ce que le métal soit complètement détruit. La corrosion la plus active du fer est causée par les solutions salines : si même un peu de chlorure d'ammonium (NH4Cl) est présent dans l'air, le processus de corrosion ira beaucoup plus vite. Dans une solution faible d'acide chlorhydrique (HCl), la réaction se déroulera également activement.
L'acide nitrique (HNO3) à une concentration supérieure à 50% entraînera une passivation du métal - il sera recouvert d'une couche protectrice, bien que fragile. L'acide nitrique vaporisé est sans danger pour le fer.
L'acide sulfurique (H2SO4) à une concentration supérieure à 70% passive le fer, et si la classe d'acier St3 est stockée dans de l'acide sulfurique à 90% à une température de 40 ° C, alors dans ces conditions le taux de corrosion ne dépassera pas 140 microns par an. Si la température est de 90 ° C, la corrosion se poursuivra à un rythme 10 fois plus élevé. L'acide sulfurique avec une concentration en fer de 50% se dissoudra.
L'acide phosphorique (H3PO4) ne corrode pas le fer, pas plus que les solvants organiques anhydres tels que les solutions alcalines, l'ammoniac aqueux, le Br2 sec et le Cl2.
Si vous ajoutez un millième de chromate de sodium à l'eau, il deviendra un excellent inhibiteur de corrosion du fer, comme l'hexamétaphosphate de sodium. Mais les ions chlore (Cl-) enlèvent le film protecteur du fer et augmentent la corrosion.Le fer est techniquement pur, contient environ 0,16% d'impuretés et est très résistant à la corrosion.
Aciers moyennement alliés et faiblement alliés
Les ajouts d'alliage de chrome, de nickel ou de cuivre dans les aciers faiblement et moyennement alliés augmentent leur résistance à l'eau et à la corrosion atmosphérique. Plus il y a de chrome, plus la résistance à l'oxydation de l'acier est élevée. Mais si le chrome est inférieur à 12%, les milieux chimiquement actifs auront un effet destructeur sur cet acier.
Aciers fortement alliés
Dans les aciers fortement alliés, les composants d'alliage représentent plus de 10 %. Si l'acier contient de 12 à 18% de chrome, cet acier résistera au contact avec presque tous les acides organiques, avec les aliments, sera résistant à l'acide nitrique (HNO3), aux bases, à de nombreuses solutions salines. Dans l'acide formique à 25 % (CH2O2), l'acier hautement allié se corrode à un rythme d'environ 2 mm par an. Cependant, les agents réducteurs forts, l'acide chlorhydrique, les chlorures et les halogènes détruisent l'acier fortement allié.
Les aciers inoxydables qui contiennent 8 à 11 % de nickel et 17 à 19 % de chrome sont plus résistants à la corrosion que les seuls aciers à haute teneur en chrome.Ces aciers résistent aux milieux oxydants acides, tels que l'acide chromique ou l'acide nitrique, ainsi qu'aux alcalins forts.
Le nickel en tant qu'additif augmentera la résistance de l'acier aux environnements non oxydants, aux facteurs atmosphériques. Mais l'environnement est acide, réducteur et acide avec des ions halogène, - ils détruiront la couche d'oxyde passivante, en conséquence, l'acier perdra sa résistance aux acides.
Les aciers inoxydables additionnés de molybdène en une quantité de 1 à 4% ont une résistance à la corrosion plus élevée que les aciers au chrome-nickel.Le molybdène donnera une résistance à l'acide sulfurique et sulfurique, aux acides organiques, à l'eau de mer et aux halogénures.
Le ferrosilicium (fer additionné de 13 à 17% de silicium), la fonte dite fer-silicium, a une résistance à la corrosion due à la présence d'un film d'oxyde de SiO2 et que ni les acides sulfurique, ni nitrique, ni chromique ne peuvent détruire, ils ne font que renforcer ce film protecteur. Mais l'acide chlorhydrique (HCl) corrodera facilement le ferrosilicium.
Alliages de nickel et nickel pur

Le nickel résiste à de nombreux facteurs, atmosphériques et de laboratoire, à l'eau propre et salée, aux sels alcalins et neutres tels que les carbonates, les acétates, les chlorures, les nitrates et les sulfates. Les acides organiques non oxygénés et non chauds n'endommageront pas le nickel, ainsi que l'hydroxyde de potassium alcalin concentré bouillant (KOH) à une concentration pouvant atteindre 60%.
La corrosion est causée par des milieux réducteurs et oxydants, des sels alcalins ou acides oxydants, des acides oxydants tels que l'azote, des halogènes gazeux humides, des oxydes d'azote et du dioxyde de soufre.
Le métal Monel (jusqu'à 67 % de nickel et jusqu'à 38 % de cuivre) est plus résistant aux acides que le nickel pur, mais ne résistera pas à l'action des acides oxydants forts. Il se distingue par une résistance assez élevée aux acides organiques, à une quantité importante de solutions salines. La corrosion atmosphérique et hydrique ne menace pas le métal monel; le fluorure est également sans danger pour lui. Le métal Monel résistera en toute sécurité à 40% de fluorure d'hydrogène (HF) bouillant comme le platine.
Alliages d'aluminium et aluminium pur

Le film d'oxyde protecteur de l'aluminium le rend résistant aux oxydants courants, à l'acide acétique, au fluor, à l'atmosphère seule et à une quantité importante de liquides organiques.L'aluminium techniquement pur, dans lequel les impuretés sont inférieures à 0,5 %, est très résistant à l'action du peroxyde d'hydrogène (H2O2).
Il est détruit par l'action de bases caustiques en milieu fortement réducteur. L'acide sulfurique dilué et l'oléum ne sont pas terribles pour l'aluminium, mais l'acide sulfurique de force moyenne le détruira, tout comme l'acide nitrique chaud.
L'acide chlorhydrique peut détruire le film protecteur d'oxyde d'aluminium. Le contact de l'aluminium avec le mercure ou les sels de mercure est destructeur pour le premier.
L'aluminium pur est plus résistant à la corrosion que, par exemple, l'alliage de duralumin (contenant jusqu'à 5,5 % de cuivre, 0,5 % de magnésium et jusqu'à 1 % de manganèse), qui est moins résistant à la corrosion. Silumin (ajoutant 11 à 14% de silicium) est plus stable à cet égard.
Alliages de cuivre et cuivre pur

Le cuivre pur et ses alliages ne se corrodent pas dans l'eau salée ou l'air. Le cuivre ne craint pas la corrosion : bases diluées, NH3 sec, sels neutres, gaz secs et la plupart des solvants organiques.
Les alliages comme le bronze, qui contiennent beaucoup de cuivre, résistent à l'exposition aux acides, même à l'acide sulfurique concentré à froid ou dilué à chaud, ou à l'acide chlorhydrique concentré ou dilué à température ambiante (25°C).
En l'absence d'oxygène, le cuivre ne se corrode pas au contact des acides organiques. Ni le fluor ni le fluorure d'hydrogène sec n'ont d'effet destructeur sur le cuivre.
Mais les alliages de cuivre et le cuivre pur sont corrodés par divers acides en présence d'oxygène, ainsi qu'au contact de NH3 humide, de certains sels acides, de gaz humides tels que l'acétylène, le CO2, le Cl2, le SO2. Le cuivre interagit facilement avec le mercure, tandis que le laiton (zinc et cuivre) est peu résistant à la corrosion.
Vérifiez plus de détails ici — Cuivre et aluminium en électrotechnique
Zinc pur

L'eau propre, comme l'air pur, ne corrode pas le zinc. Mais s'il y a des sels, du dioxyde de carbone ou de l'ammoniac dans l'eau ou l'air, la corrosion du zinc commencera. Le zinc se dissout dans les bases, particulièrement rapidement — dans l'acide nitrique (HNO3), plus lentement — dans les acides chlorhydrique et sulfurique.
Les solvants organiques et les produits pétroliers n'ont généralement pas d'effet corrosif sur le zinc, mais si le contact est prolongé, par exemple avec de l'essence craquée, l'acidité de l'essence augmentera en s'oxydant à l'air et la corrosion du zinc commencera.
Plomb pur

La haute résistance du plomb à l'eau et à la corrosion atmosphérique est un fait bien connu. Il ne se corrode pas je mène et quand dans le sol. Mais si l'eau contient beaucoup de dioxyde de carbone, le plomb s'y dissoudra, car du bicarbonate de plomb se formera, qui sera déjà soluble.
En général, le plomb est très résistant aux solutions neutres, moyennement résistant aux solutions alcalines, ainsi qu'à certains acides : sulfurique, phosphorique, chromique et sulfurique. Avec de l'acide sulfurique concentré (à partir de 98%) à une température de 25 ° C, le plomb peut se dissoudre lentement.
Le fluorure d'hydrogène à une concentration de 48 % dissout le plomb lorsqu'il est chauffé. Le plomb réagit fortement avec les acides chlorhydrique et nitrique, avec l'acide formique et acétique. L'acide sulfurique recouvrira le plomb d'une couche légèrement soluble de chlorure de plomb (PbCl2) et aucune dissolution supplémentaire ne se produira. Dans l'acide nitrique concentré, le plomb sera également recouvert d'une couche de sel, mais l'acide nitrique dilué dissoudra le plomb. Les chlorures, les carbonates et les sulfates ne sont pas agressifs envers le plomb, alors que les solutions de nitrate sont à l'opposé.
Titane pur

Une bonne résistance à la corrosion est une caractéristique du titane.Il n'est pas oxydé par les oxydants forts, résiste aux solutions salines, FeCl3, etc. Les acides minéraux concentrés provoqueront de la corrosion, mais même l'acide nitrique bouillant à une concentration inférieure à 65%, l'acide sulfurique - jusqu'à 5%, l'acide chlorhydrique - jusqu'à 5% - ne provoquera pas la corrosion du titane. La résistance normale à la corrosion des bases, des sels alcalins et des acides organiques distingue le titane des autres métaux.
Zirconium pur

Le zirconium est plus résistant aux acides sulfurique et chlorhydrique que le titane, mais moins résistant à l'aquarégie et au chlore humide. Il a une résistance chimique élevée à la plupart des bases et des acides, résistant au peroxyde d'hydrogène (H2O2).
L'action de certains chlorures, de l'acide chlorhydrique concentré bouillant, de l'eau régale (mélange de HNO3 nitrique concentré (65-68 % en poids) et de HCl salin (32-35 % en poids), d'acide sulfurique concentré chaud et d'acide nitrique fumant En ce qui concerne la corrosion, il s'agit d'une propriété du zirconium telle que l'hydrophobicité, c'est-à-dire que ce métal n'est mouillé ni par l'eau ni par les solutions aqueuses.
Tantale pur

L'excellente résistance chimique du tantale est similaire à celle du verre. Son film d'oxyde dense protège le métal jusqu'à 150°C de l'action du chlore, du brome, de l'iode. La plupart des acides dans des conditions normales n'agissent pas sur le tantale, même l'aquarégie et l'acide nitrique concentré ne provoquent pas de corrosion. Les solutions alcalines n'ont pratiquement aucun effet sur le tantale, mais le fluorure d'hydrogène agit dessus et des solutions alcalines chaudes concentrées sont utilisées, des fondus alcalins sont utilisés pour dissoudre le tantale.
