Quelle est la différence entre le graphène et le graphite ?
Un élément chimique remarquable, le carbone est celui qui se situe commodément au numéro 6 dans le quatorzième groupe de la deuxième période du tableau périodique des éléments chimiques. Depuis l'Antiquité, les gens connaissent le diamant et le graphite, deux des plus de neuf modifications allotropiques de cet élément découvertes à ce jour. Soit dit en passant, c'est le carbone qui a le plus grand nombre de modifications allotropiques, par rapport à d'autres substances, connues de la science moderne.
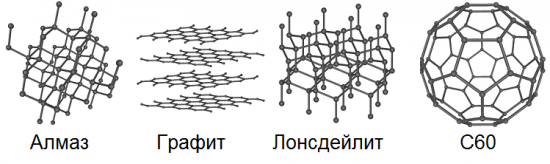
L'allotropie implique la possibilité de l'existence dans la nature du même élément chimique sous la forme de deux ou plusieurs substances simples, les formes dites allotropiques ou modifications allotropiques, qui provoquent des différences dans ces substances à la fois dans la structure et les propriétés. Ainsi, le carbone a 8 formes de base : diamant, graphite, lonsdaleite, fullerènes (C60, C540 et C70), carbone amorphe et nanotube à paroi unique.
Parmi ces formes de carbone, il existe des propriétés et des caractères complètement différents : des substances molles et dures, transparentes et opaques, bon marché et chères. Cependant, comparons deux modifications similaires du carbone - le graphite et le graphène.

Nous connaissons tous le graffiti depuis l'école.La mine d'un crayon ordinaire est exactement du graphite. Il est assez doux, glissant et gras au toucher, les cristaux sont des plaques, les couches d'atomes sont situées les unes au-dessus des autres, donc lors du frottement, par exemple, sur du papier, des flocons individuels de la structure cristalline en couches du graphite se décollent facilement , laissant une trace sombre caractéristique sur le papier.
Le graphite conduit bien le courant électrique, sa résistance est en moyenne de 11 Ohm * mm2/m, mais la conductivité du graphite n'est pas la même du fait de l'anisotropie naturelle de ses cristaux. Ainsi, la conductivité le long des plans du cristal est des centaines de fois supérieure à la conductivité dans ces plans. La densité du graphite est de 2,08 à 2,23 g/cm3.
Dans la nature, le graphite se forme à haute température dans les roches ignées et volcaniques, dans les skarns et les pegmatites. Il se produit dans des veines de quartz avec des minéraux dans des dépôts polymétalliques hydrothermaux à température intermédiaire. Il est largement distribué dans les roches métamorphiques.
Ainsi, depuis 1907, les plus grandes réserves mondiales de graphite naturel en paillettes ont été exploitées sur l'île de Madagascar. L'île est constituée de roches métamorphiques précambriennes qui remontent à la surface dans un terrain montagneux avec des marques hypsométriques de 4 000 à 4 600 pieds. Le graphite se trouve ici dans une ceinture de 400 miles de long et domine les montagnes dans la partie orientale du centre de l'île.
Le graphène, contrairement au graphite, n'a pas de structure cristalline en vrac; il présente un réseau cristallin hexagonal bidimensionnel, d'un seul atome d'épaisseur. Dans une telle modification allotropique, le carbone ne se produit pas du tout naturellement, mais peut théoriquement être obtenu artificiellement. Nous pouvons dire qu'un plan délibérément séparé de la structure cristalline massive multicouche du graphite sera ce même graphène.
Les scientifiques n'ont d'abord pas pu obtenir de graphène sous la forme d'un simple film bidimensionnel, en raison de l'instabilité de la matière sous cette forme. Cependant, sur un substrat d'oxyde de silicium (en raison de la liaison avec la couche diélectrique), il était encore possible d'obtenir du graphène d'un atome d'épaisseur : en 2004, les scientifiques russes Andrey Geim et Konstantin Novoselov de l'Université de Manchester ont publié un rapport dans Science sur l'obtention de graphène de cette manière.
Et même aujourd'hui, des méthodes aussi simples d'obtention de graphène pour la recherche, telles que l'exfoliation mécanique d'une monocouche de carbone à partir d'un cristal de graphite massif à l'aide de ruban adhésif (et de méthodes similaires), sont justifiées.
Les chercheurs pensent que grâce à leurs progrès, une nouvelle classe de nanoélectronique à base de graphène émergera bientôt, où les transistors à effet de champ auront une épaisseur inférieure à 10 nm. Le fait est que la mobilité des électrons dans le graphène est si élevée (10 000 cm2 / V * s) qu'il semble être l'alternative la plus prometteuse au silicium conventionnel aujourd'hui.
La mobilité élevée des porteurs est la capacité des électrons et des trous à réagir extrêmement rapidement à l'effet des champs électriques appliqués, ce qui est extrêmement important pour les transistors à effet de champ, l'unité de fonctionnement de base de l'électronique moderne.
Il existe également des perspectives de création de divers capteurs biologiques et chimiques, ainsi que des couches minces pour les dispositifs photovoltaïques et les écrans tactiles. Malgré tout cela, la conductivité thermique du graphène est 10 fois supérieure à celle du cuivre, et ce critère est toujours très important pour l'électronique.