Comment les piles fonctionnent et fonctionnent
 Au sens le plus large du terme en technologie, le terme "batterie" désigne un appareil qui permet dans certaines conditions de fonctionnement d'accumuler un certain type d'énergie, et dans d'autres de l'utiliser pour les besoins humains.
Au sens le plus large du terme en technologie, le terme "batterie" désigne un appareil qui permet dans certaines conditions de fonctionnement d'accumuler un certain type d'énergie, et dans d'autres de l'utiliser pour les besoins humains.
Ils sont utilisés lorsqu'il est nécessaire de collecter de l'énergie pendant un certain temps, puis de l'utiliser pour effectuer de grands processus à forte intensité de main-d'œuvre. Par exemple, les accumulateurs hydrauliques utilisés dans les écluses permettent aux navires de s'élever à un nouveau niveau sur le lit du fleuve.
Les batteries électriques fonctionnent avec de l'électricité sur le même principe : d'abord, elles accumulent (accumulent) de l'électricité à partir d'une source de charge externe, puis la donnent aux consommateurs connectés pour qu'ils fonctionnent. De par leur nature, ils appartiennent à des sources de courant chimiques capables d'effectuer des cycles périodiques de décharge et de charge de manière répétée.
Pendant le fonctionnement, des réactions chimiques se produisent constamment entre les composants des plaques d'électrodes avec leur substance de remplissage - l'électrolyte.
Un diagramme schématique d'un dispositif de batterie peut être représenté par un dessin simplifié lorsque deux plaques de métaux différents avec des fils sont insérées dans le corps du récipient pour fournir des contacts électriques. Un électrolyte est coulé entre les plaques.
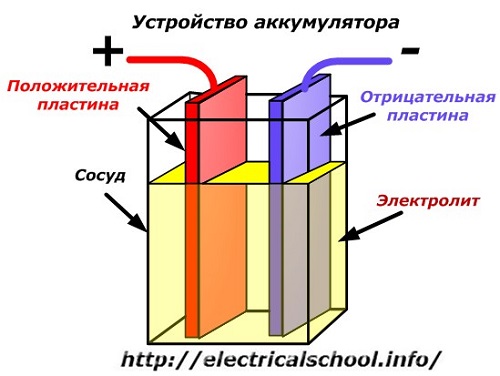
Fonctionnement de la batterie lorsqu'elle est déchargée
Lorsqu'une charge, telle qu'une ampoule, est connectée aux électrodes, un circuit électrique fermé est créé à travers lequel circule le courant de décharge. Il est formé par le mouvement des électrons dans les pièces métalliques et des anions avec des cations dans l'électrolyte.
Ce procédé est classiquement représenté sur un schéma avec une conception d'électrode nickel-cadmium.
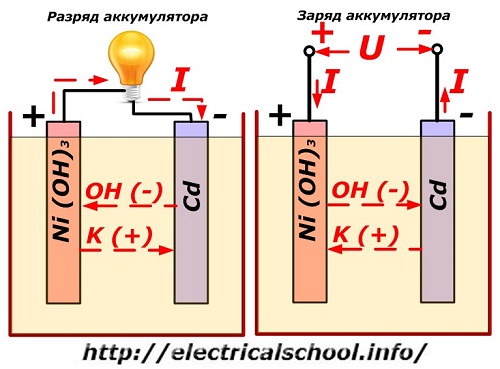
Ici, des oxydes de nickel avec des additifs de graphite, qui augmentent la conductivité électrique, sont utilisés comme matériau de l'électrode positive. Le métal de l'électrode négative est du cadmium spongieux.
Lors de la décharge, les particules d'oxygène actif des oxydes de nickel sont libérées dans l'électrolyte et dirigées vers les plaques négatives, où le cadmium est oxydé.
Performances de la batterie lors de la charge
Lorsque la charge est éteinte, une tension constante (dans certaines situations, pulsée) est appliquée aux bornes de la plaque d'une valeur supérieure à celle d'une batterie chargée de même polarité, lorsque les bornes plus et moins de la source et du consommateur coïncident .
Le chargeur a toujours plus de puissance, ce qui "supprime" l'énergie résiduelle dans la batterie et crée un courant électrique dans le sens inverse de la décharge. En conséquence, les processus chimiques internes entre les électrodes et l'électrolyte changent. Par exemple, sur une boîte de plaques de nickel-cadmium, l'électrode positive est enrichie en oxygène et la négative - à un état de cadmium pur.
Lorsque la batterie est déchargée et chargée, la composition chimique du matériau des plaques (électrodes) change, mais l'électrolyte ne change pas.
Méthodes de connexion de la batterie
Connexion parallèle
La quantité de courant de décharge qu'une personne peut supporter dépend de nombreux facteurs, mais principalement de la conception, des matériaux utilisés et de leurs dimensions. Plus la surface des plaques au niveau des électrodes est grande, plus le courant qu'elles peuvent supporter est important.
Ce principe est utilisé pour connecter des cellules du même type en parallèle dans des batteries lorsqu'il est nécessaire d'augmenter le courant à la charge.Mais pour charger une telle conception, il faudra augmenter la puissance de la source. Cette méthode est rarement utilisée pour les structures prêtes à l'emploi, car il est maintenant beaucoup plus facile d'acheter immédiatement la batterie nécessaire. Mais les fabricants de batteries acides l'utilisent, connectant différentes plaques en blocs uniques.
Connexion série
Selon les matériaux utilisés, une tension de 1,2 / 1,5 ou 2,0 volts peut être générée entre les deux plaques électrodes des batteries courantes dans la vie courante. (En fait, cette plage est beaucoup plus large.) Évidemment, ce n'est pas suffisant pour de nombreux appareils électriques. Par conséquent, les batteries du même type sont connectées en série, et cela se fait souvent dans un seul cas.
Un exemple d'une telle conception est le développement automobile généralisé basé sur l'acide sulfurique et les plaques d'électrodes en plomb.
Habituellement, parmi les gens, en particulier parmi les chauffeurs de transport, il est d'usage d'appeler tout appareil une batterie, quel que soit le nombre de ses éléments constitutifs - les boîtes. Cependant, ce n'est pas tout à fait correct.La structure, assemblée à partir de plusieurs boîtiers connectés en série, est déjà une batterie, pour laquelle le nom abrégé «АКБ» est apposé... Sa structure interne est illustrée sur la figure.
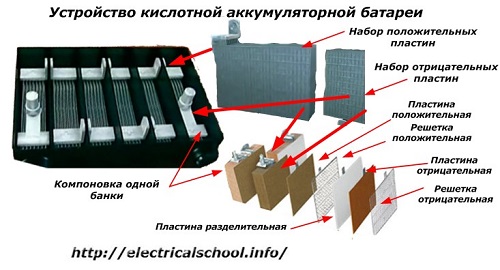
Chacun des pots se compose de deux blocs avec un ensemble de plaques pour les électrodes positives et négatives. Les blocs s'emboîtent sans contact métallique avec la possibilité d'une connexion galvanique fiable à travers l'électrolyte.
Dans ce cas, les plaques de contact comportent une grille supplémentaire et sont séparées les unes des autres par une plaque séparatrice.
La connexion des plaques en blocs augmente leur zone de travail, réduit la résistance totale de l'ensemble de la structure et vous permet d'augmenter la puissance de la charge connectée.
A l'extérieur du boîtier, une telle batterie comporte les éléments représentés sur la figure ci-dessous.
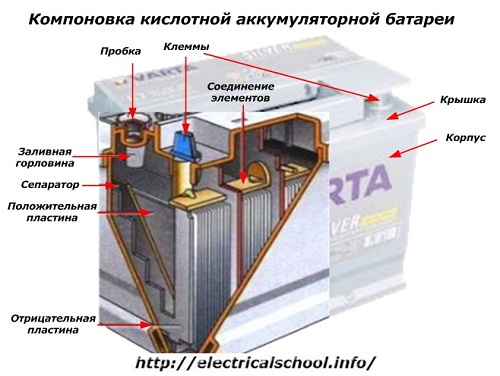
Il montre que le boîtier en plastique robuste est scellé avec un couvercle et équipé de deux bornes (généralement en forme de cône) sur le dessus pour la connexion au circuit électrique de la voiture. Des repères de polarité sont gravés sur leurs bornes : « + » et « - ». Habituellement, la borne positive a un diamètre légèrement plus grand que la borne négative pour bloquer les erreurs de câblage.
Les batteries utilisables ont un trou de remplissage sur le dessus de chaque bocal pour contrôler le niveau d'électrolyte ou ajouter de l'eau distillée pendant le fonctionnement. Un bouchon y est vissé, ce qui protège les cavités internes du boîtier de la contamination et empêche en même temps l'électrolyte de se répandre lorsque la batterie est inclinée.
Puisqu'avec une charge puissante, le gazage de l'électrolyte est possible (et ce processus est possible lors d'une conduite intensive), des trous sont pratiqués dans les bouchons pour empêcher la pression à l'intérieur de la boîte d'augmenter.L'oxygène et l'hydrogène, ainsi que les vapeurs d'électrolyte, sortent à travers eux. Il est recommandé d'éviter de telles situations impliquant des courants de charge excessifs.
La même figure montre la connexion des éléments entre les bancs et la disposition des plaques d'électrodes.
Les batteries de démarrage de voiture (plomb-acide) fonctionnent sur le principe de la double sulfatation. Lors de la décharge / charge, un processus électrochimique se produit sur celles-ci, accompagné d'une modification de la composition chimique de la masse active des électrodes avec libération / absorption d'eau dans l'électrolyte (acide sulfurique).
Ceci explique l'augmentation de la densité de l'électrolyte lors de la charge et la diminution lorsque la batterie est déchargée. En d'autres termes, la valeur de densité permet d'évaluer l'état électrique de la batterie. Un appareil spécial est utilisé pour le mesurer - un hydromètre de voiture.
L'eau distillée, qui fait partie de l'électrolyte des batteries acides, se transforme en un état solide - de la glace à des températures négatives.Par conséquent, afin d'éviter que les batteries de voiture ne gèlent par temps froid, il est nécessaire d'appliquer les mesures spéciales prévues dans les règles pour exploitation.
Quels types de piles existe-t-il ?
La production moderne à des fins diverses produit plus de trois douzaines de produits avec différentes compositions d'électrodes et d'électrolytes. 12 modèles connus fonctionnent uniquement au lithium.

Les éléments suivants peuvent être trouvés comme métal d'électrode :
-
mener;
-
fer;
-
lithium;
-
titane;
-
cobalt;
-
cadmium;
-
nickel;
-
zinc;
-
argent;
-
vanadium;
-
aluminium
-
quelques autres éléments.
Ils affectent les caractéristiques de sortie électrique et donc l'application.
La capacité à supporter des charges élevées à court terme résultant de la rotation des vilebrequins des moteurs à combustion interne par des démarreurs électriques est caractéristique des batteries au plomb. Ils sont largement utilisés dans les transports, les alimentations sans coupure et les systèmes d'alimentation de secours.
Standard cellules galvaniques (batteries normales) sont généralement remplacées par des batteries nickel-cadmium, nickel-zinc et nickel-hydrure métallique.
Mais les conceptions lithium-ion ou lithium-polymère fonctionnent de manière fiable dans les appareils mobiles et informatiques, les outils de construction et même les véhicules électriques.
Selon le type d'électrolyte utilisé, les batteries sont :
-
aigre
-
alcalin.
Il existe une classification des batteries en fonction de leur objectif. Par exemple, dans les conditions modernes, des appareils sont apparus qui sont utilisés pour le transfert d'énergie - recharger d'autres sources. La batterie dite externe aide les propriétaires de nombreux appareils mobiles en l'absence de réseau électrique alternatif. Il est capable de recharger à plusieurs reprises une tablette, un smartphone, un téléphone portable.
Toutes ces batteries ont le même principe de fonctionnement et un dispositif similaire. Par exemple, le modèle de doigt lithium-ion illustré dans la figure ci-dessous répète à bien des égards la conception des batteries à acide décrites précédemment.
Ici, nous voyons les mêmes électrodes de contact, plaques, séparateur et boîtier. Seulement, ils sont fabriqués en tenant compte d'autres conditions de travail.
Caractéristiques électriques de base d'une batterie
Le fonctionnement de l'appareil est affecté par les paramètres :
-
capacité;
-
densité d'énergie;
-
auto-décharge ;
-
régime de température.
La capacité est appelée la charge maximale de la batterie, qu'elle est capable de donner lors de la décharge à la tension la plus basse. Elle est exprimée en pendentifs (système SI) et en ampères-heures (unité hors système).
Comme type de capacité, il y a la «capacité énergétique», qui détermine l'énergie libérée lors de la décharge à la tension minimale admissible. Elle est mesurée en joules (SI) et en wattheures (unités non SI).
Densité d'énergie exprimée comme le rapport entre la quantité d'énergie et le poids ou le volume de la batterie.
L'autodécharge considère la perte de capacité après la charge en l'absence de charge sur les bornes. Cela dépend de la conception et est exacerbé par les ruptures d'isolation entre les électrodes pour de nombreuses raisons.
La température de fonctionnement affecte les propriétés électriques et en cas de graves écarts par rapport à la norme spécifiée par le fabricant, elle peut endommager la batterie. La chaleur et le froid sont inacceptables, ils affectent le déroulement des réactions chimiques et la pression de l'environnement à l'intérieur de la boîte.
